引言:脉冲电场消融(Pulsed field ablation,PFA)技术基于不可逆电穿孔(IRE)效应的独特非热和选择性消融机制,为心脏电生理领域带来了革命性的创新治疗手段。网络上和文献数据库中已经有大量关于PFA原理和研究进展等方面报道,但PFA技术最初究竟如何被发现?又如何迅速从实验室走向临床应用?这个过程可谓跌宕起伏、精彩纷呈,充满了激情创新和激烈竞争。我们以科学技术发展史的视角,来回顾PFA技术在心脏电生理消融领域中的历史研究进程,呈现出PFA创新治疗技术研究过程的精彩故事。
导 读
Part 1 独领风骚——PFA的非热和选择性IRE消融机制:简要介绍PFA治疗原理和技术优势
Part 2 擦肩而过——IRE技术临床应用的早期研究探索:高压脉冲的IRE机制被发现后,该领域的全球各研究人员开展了IRE最佳临床治疗适应症的探索,针对人体各个部位,“从头到脚”,上下求索,开展了非常多的基础和临床前研究,但很遗憾,他们过于关注肿瘤消融,而偏偏错过了心脏电生理领域的临床应用探索。
Part 3沧海遗珠——心脏电生理消融被发现为IRE的最佳临床应用:在IRE研究人员苦苦追寻最佳适应症和推广肿瘤消融临床应用(纳米刀)的过程中,心脏电生理专家已悄悄发现,IRE在心脏电生理消融领域的临床应用才把IRE的技术优势发挥到了极致,可谓“沧海遗珠现光芒”。
Part 4一鸣惊人——脉冲电场消融(PFA)名词的诞生和首次临床应用:心脏电生理领域的研究人员在2011~2017年之间开展一系列临床前研究后,越来越认识到IRE在心脏电生理消融方面的替代性优势,最终于2018年迅速开展了全球首次临床应用(临床研究),并提出了一个更响亮的名字:“脉冲电场消融(PFA)”;首次临床研究后,PFA这项新技术可谓一鸣惊人,受到了学术界、临床界和产业界的高度重视。
Part 5 丰功伟绩——让我们铭记的推动PFA技术进步的那些人:无论是擦肩而过的遗憾,还是斩获沧海遗珠的幸运,这些人都在默默推动PFA技术和临床应用的进步,都为人类疾病的创新治疗手段做出了丰功伟绩,值得我们铭记。
Part 6 展望未来——PFA技术的未来:任何技术需要持续迭代和改进,PFA还只是刚刚开始,还并不完美,那PFA的未来是什么?What’s the next?
Part 1 独领风骚——PFA的非热和选择性IRE消融机制
当细胞置于电场中,如利用导管或电极针向组织传递电脉冲能量时,会在细胞膜上产生跨膜电压。当电场达到一定程度时,会在细胞膜上积累电荷,可能在膜表面形成纳米级孔洞,从而增加膜的渗透性。细胞膜本身是非导电的,但在电场作用下,电荷会在膜两侧积聚,产生感应跨膜电压。当细胞膜上的总跨膜电压(由静息跨膜电压和感应跨膜电压组成)达到一个临界值时,就会发生可逆电穿孔(Reversible electroporation,RE);当电场足够强时,细胞会发生不可逆电穿孔(Irreversible electroporation,IRE)。细胞不可逆电穿孔是一种非热能源,细胞死亡诱导不依赖于热过程,电场施加到细胞上,导致细胞膜完整性和功能的破坏,最终导致细胞死亡和替代纤维化。
![]()
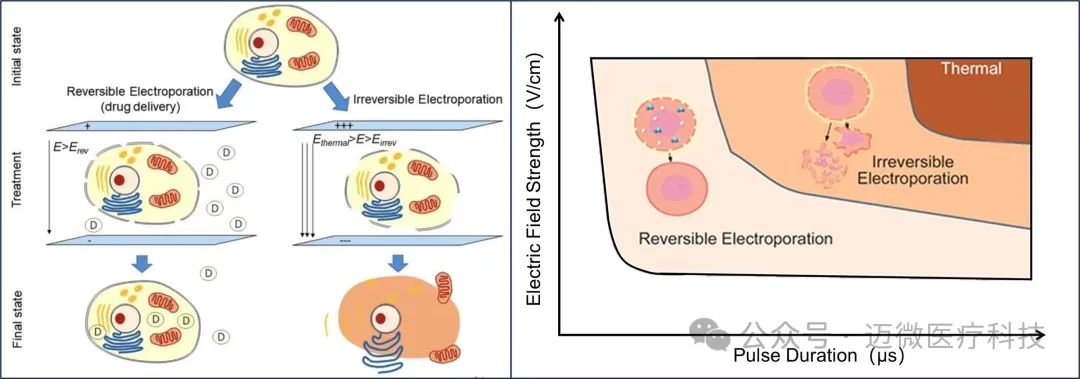
图1 电穿孔作用机理及电场强度与电穿孔关系研究[1, 2]
Part 2 擦肩而过——IRE技术临床应用的早期研究探索
人类科学技术探索历史中,对于新现象、新原理和新机制的科学探索,往往会呈现出多个研究团队同时开展和竞争的情况,他们往往从不同路径、不同切入点开展研究,但均取得了同样的研究成果,推动了该领域的科技发展。在PFA技术领域的研究历程同样精彩纷呈,耐人寻味。
与电穿孔相关的研究最早始于18世纪,但仅观察到IRE现象,并未确定电穿孔可增加细胞膜的通透性。(Nollet于1754年撰写专著描述了电场实验中,人类和动物身上出现电火花的地方,有红色斑点形成;Fuller于1898年发现高压排水管对水样品有一定的杀菌作用)。在19世纪80年代,导管介导的单相脉冲电穿孔技术首次被应用于心脏组织的治疗。但时这种方法存在一些严重的副作用,比如产生感应电,可能导致“蒸气球”效应,进而引发火花放电(电弧),产生爆炸和破坏性的压力波,导致气压伤和促心律失常效应,限制了单相脉冲电穿孔技术的临床应用。随着科学技术的发展,IRE开始被尝试应用于各个领域,如下图所示:

图2 IRE技术在各个行业的应用
大量研究团队将IRE广泛应用于各个组织消融领域,期望找到最适合IRE技术临床应用的适应症,如以加州大学Rubinsky教授为代表的IRE研究人员早期将IRE技术应用于肝癌、前列腺、颈动脉等,开展了大量的动物研究[3, 4],同时也进行了心脏相关的研究[5]。
Part 3 沧海遗珠——心脏电生理消融被发现为IRE的最佳临床应用
2007年Rubinsky教授和以色列Sheba Medical Center(希巴医疗中心,全球第9大医院)的Lavee教授合作,利用IRE在猪心外膜心房消融的结果显示,PFA 作为新能量形式可非常迅速、精确和完全地进行跨壁消融,而无局部加热效应。从整个PFA技术发展历程而言,是全球范围首次开展的IRE在心肌组织消融方面的研究,但该研究团队重心在其他组织消融领域(如肿瘤治疗),未对其进行深入性研究,甚至该团队在之后很长一段时间均放弃了对心脏IRE消融的研究工作。2009年美敦力心血管部的Jinback Hong采用美敦力除颤仪和美敦力自研的高压脉冲源证明了电穿孔消融方法可以在安全情况下产生跨壁损伤,且消融过程中具有保护食道的效果,有望预防消融术中的严重并发症。
直到2011年,荷兰University Medical Center Utrecht(乌特勒支大学医学中心)的Wittkampf教授受到心房电击可造成局部消融损伤(乌特勒支大学医学中心的Richard教授在1986年的发现[6]以及荷兰莱顿大学医学中心的Wijffels教授2007年的研究[7])的启发,使用类似于Lasso环形标测导管的环形消融导管,通过除颤仪的单极性脉冲输出,在全球范围首次证明了采用IRE技术电隔离肺静脉的大动物临床前可行性[8],为IRE作为一种安全有效的房颤消融方式提供了临床前证据。
此后,Wittkampf教授发现了IRE在心脏消融领域的可行性及优势,在随后几年内密集开展了大量动物实验,共计60多头动物,并先后在心房和心室处的心外膜及心内膜开展手术,通过单极性环形消融导管和除颤仪研究了IRE消融术在心脏消融领域的有效性和安全性。首先于2012年证明了脉冲能量可产生连续的环形心肌组织损伤,其深度可形成肺静脉隔离,并发现损伤深度随脉冲能量的增加而增加,而后2013~2014年通过多次实验在心外膜与心内膜均验证了IRE消融可以安全地应用于冠状动脉附近甚至冠状动脉上,且动脉血流不会影响损伤的形成,并发现能量越高,所产生的组织收缩越明显。2014年~2017年验证了IRE在肺静脉隔离过程中的优势,PFA相较于RFA不会引起肺静脉狭窄。并且验证了IRE在消融过程中不会影响膈神经功能及造成食管结构损伤。而当时Wittkampf教授团队一直采用单极性环形导管和除颤仪进行输出,无法输出较优的波形与脉冲,因此无法解决一些棘手(如肌肉收缩等)的问题。Wittkampf教授从2011-2017年的研究系统性的验证了IRE在心脏消融领域的有效性与安全性,为这一技术的发展奠定了基础,推动了IRE在心脏消融的发展,为心律失常的治疗提供了新的视角和方法,并被其他电生理专家关注,推动了IRE在心脏治疗临床方向的应用。
在2014~2015年,多位国际电生理大师如美国梅奥医学中心的Samuel Asirvatham教授、美国University of Oklahoma Health Sciences Center(俄克拉荷马大学健康科学中心)的Hiroshi Nakagawa教授、美国Brigham and Women’s Hospital的Kumar教授和Michaud教授(后担任美国麻省总医院心律失常中心主任)、美国杜克大学医学中心的Barnett和Piccini教授均在著名期刊中发表了综述文献[9-12],先后介绍了Wittkampf教授团队的工作和不可逆电穿孔技术在心脏电生理消融方面的潜在优势和需要解决的问题,并且表明了其极有可能在心脏电生理消融领域获得重要的临床应用。同时,Samuel 教授开展了大量相关研究,并对IRE技术在心脏消融领域的应用进行了改进与优化。他的研究对导管输出方式进行了优化,首次使用双极性脉冲IRE导管消融并结合心电图和三维标测(Carto,Biosense-Webster)来评估心肌信号,该研究同样验证了IRE在心房组织消融的有效性及安全性。而后又证明IRE可选择性消融Purkinje组织而不损伤其他心肌组织。随后于2018年验证了使用单侧绝缘导进行心外膜消融是可行的,其既能保证心外膜方向性,又能保护膈神经;并改进了球囊IRE消融导管,证明其的有效性及对膈神经、肺静脉、食道的保护作用。下图为IRE在心脏消融领域的研究历程,详细介绍了IRE在心脏消融领域的研究进展。

图3 脉冲电场在心脏消融领域的研究历程
Samuel教授于2017年发表综述文章[13],评论心脏电生理临床领域在2018年及未来可能产生的新技术与挑战。文中也重点介绍了IRE技术的研究进展,并指出IRE技术可能是心脏电生理消融能量模态的未来!2018年同样表了综述文章,重点介绍并解释了IRE的生物物理学原理、目前基于热效应的方法的局限性,并审查了目前已发表的有关电穿孔心脏消融的数据。Samuel认为,IRE是一种快速发展的新型消融方式,与目前基于热效应的方法相比具有很多优势。目前的动物模型研究表明,IRE可安全有效地应用于心脏。虽然还需要进一步的研究,但IRE是心律失常消融的一种极具吸引力的选择。从IRE技术在心脏电生理领域的临床优势和研究历程可见,心脏电生理堪称其在肿瘤消融领域之外的一个最佳临床应用,但瞄准肿瘤消融的纳米刀(NanoKnife)在2012年即获得了FDA认证,并在肝癌和胰腺癌的消融治疗领域迅速得到了临床界的认可。那为何在纳米刀开展临床应用和崭露头角之后,IRE技术才开始在心脏电生理领域展开系统的研究和逐步受到重视呢?IRE研究人员在开展“从头到脚”的研究过程中,就恰好忽略了心脏电生理这个领域?带着这个疑问,我们再次回顾图2、图3的研究历程,才知道IRE在心脏电生理领域的重视源自于心脏电生理领域的学者,且来自于意外的发现(乌特勒支大学医学中心的Richard教授在1986年的发现——体内导管除颤时,导管电极处产生了心肌组织损伤),而不是带着目的、有意图的“从头到脚”式的搜寻。真所谓“有心栽花花不开,无心插柳柳成荫”!
Part 4 一鸣惊人——脉冲电场消融(PFA)名词的诞生和首次临床应用
2018年,美国西奈山医院的Reddy教授开展了全球首次房颤临床研究(采用美国Farapulse公司的产品),该研究针对两个中心的22 位患者,在全身麻醉下接受了IRE消融术:其中15位心内膜消融,7位心外膜消融。导管PV隔离术在15名患者(100%)的所有57个PV中均获得成功。手术时间为 67 ± 10.5分钟,导管时间(导管进入到退出)为19 ± 2.5分钟,脉冲电场(PEF)能量传输总时间<60 s/患者,透视时间为12 ± 4.0分钟。心外膜消融的导管时间为50.7 ± 19.5分钟。无并发症发生。这项研究开创了房颤组织特异性超快速消融的新时代(但当时对IRE在心脏消融上的名称还是PEF),也拉开了全球追崇IRE在心脏电生理领域的临床研究序幕。
Samuel教授发表综述文章[14]回顾了2018年Heart Rhythm Society (HRS)大会上报道的心律方面的创新技术,其中重点介绍了Reddy教授开展的全球首个First-in-man的PFA临床研究工作(当时还没有PFA的名称,只是把IRE在心脏电生理消融领域的应用称为PEF:pulsed electric fields)。同年,Wittkampf教授在JACC上发表综述文章[15],系统地介绍了电穿孔消融心肌组织的研究历史,并介绍了心肌组织阻抗特性、电穿孔阈值、组织选择性等,也对IRE消融心肌组织的高效率,防止肺静脉狭窄,保护冠脉、膈神经和食道等优势。在这篇综述中,Wittkampf教授也特别提到了IRE在血液中的气泡产生问题,也指出导管电极贴靠是影响消融效果的重要因素!2018年,美国心脏病学会(American College of Cardiology)将IRE在心脏消融领域的应用称为PFA(Pulsed field ablation),之后,行业内逐渐开始使用PFA这一名称。2019年,美敦力心律部门的Stewart和Oakland University William Beaumont School of Medicine(奥克兰大学威廉博蒙特医学院)的Haines教授合作,报道了美敦力的“黄金圈”导管,文章中同样采用了Pulsed field ablation(PFA)的概念。2019年,Reddy教授继续报道了Farapulse的临床研究,文章中继续使用了PFA的称呼。
从2018年Reddy教授的首个临床应用至今,学术界和产业界均开展了大量的研究和产品开发工作,适应症包括阵发性房颤、持续性房颤、室上速等,PFA可能成为房颤治疗的替代性技术。
Part 5 丰功伟绩——让我们铭记的推动PFA技术进步的那些人
在脉冲电场消融(PFA)技术的发展初期,多位国际知名的科学家为其进步做出了巨大贡献。在发展初期,IRE领域专家初次在PEF对心脏领域进行尝试, Rubinsky教授和Lavee教授合作进行心外膜跨壁消融是全球范围首次开展的IRE在心肌组织消融方面的研究,初次验证了IRE的可行性,为之后的研究打下基础,尽管结果展现出一定的优势,但并未立即受到广泛关注,未对其进行深入性研究。

Rubinsky教授
美敦力心血管部的Jinback Hong等人是企业中较早对PEF在心脏治疗领域的消融潜力产生浓厚兴趣并进行验证与发展的,并且对脉冲发生源进行优化改进,提高消融效率,为之后的产品开发及研究奠定了基础。美敦力在如此早期就开展了IRE在心脏电生理领域的研究工作,让我们不得不佩服国际巨头的研究实力和对前沿创新技术的跟踪能力。
心脏电生理领域专家Wittkampf教授团队在之前课题组的研究基础上深入探索了PFA的应用基础和潜力,并通过大量实验系统性验证了其有效性和安全性(没错,就是他,鼎鼎大名的Wittkampf教授,那位提出三维电生理建模电定位专利技术LocaLisa的大牛专家[16]),为这一技术的发展奠定了基础,推动了IRE在心脏消融的发展,为心律失常的治疗提供了新的视角和方法,并被其他电生理专家关注,推动了IRE在心脏治疗临床方向的应用。

低调到找不到照片的荷兰乌特勒支大学医学中心Wittkampf教授(也是大名鼎鼎的LocaLisa三维电定位技术发明人)
多位心脏电生理学专家对PFA技术进行进一步的研究和优化,如Samuel教授开展了大量相关研究对导管输出方式等方向进行了优化,总结了不可逆电穿孔技术在心脏电生理消融方面的潜在优势和需要解决的问题,并且表明了其极有可能在心脏电生理消融领域获得重要的临床应用。随着这些科学家关注和推动,PFA技术逐渐受到重视,并开始在心脏电生理学领域崭露头角。

美国梅奥医学中心Samuel J Asirvatham教授
心脏电生理领域专家Reddy教授开展了全球首次房颤临床研究中采用的美国Farapulse公司的产品,其成为了PFA领域的先驱,其独特的花键结构消融导管能够适应不同的肺静脉形态,实现稳定贴靠,提升临床操作的灵活性,并快速释放能量,提高了手术效率。Farapulse在导管设计上实现了巨大的创新,并最早开始进行临床研究,大大推动了PFA技术的发展。

美国西奈山医院的Vivek Reddy教授
Part 6 展望未来——PFA技术的未来
自2007年首次在心肌组织消融研究中应用以来,PFA技术经历了快速的发展和创新。早期研究主要集中在动物模型上,探索PFA对心肌细胞的损伤效果及其安全性。随后,研究逐渐深入,包括对PFA技术心房颤动治疗等方面的应用进行评估。经过数十年的研究与发展,脉冲电场消融(PFA)技术已经在心脏治疗领域取得了令人瞩目的成就。从基础科学对电穿孔现象的探索,到临床实践中的创新应用,PFA技术展现了其在治疗心律失常,尤其是房颤方面的巨大潜力。这一技术的发展不仅为我们提供了一种新的治疗手段,而且也推动了我们对心脏电生理学和细胞生物学的深入理解。随着技术的不断成熟和临床试验的深入,PFA技术已成为心脏疾病治疗的新选择,为心律失常患者带来了新的希望。展望未来,PFA技术的研究和应用将继续优化,随着更多的临床数据的积累和新技术的融合,PFA技术有望为全球患者带来更多的治疗选择和更好的生活质量。
任何技术需要持续迭代和改进,PFA未来发展趋势将集中在技术创新、导管形态优化、脉冲参数设置等方面,提高手术的安全性和有效性。现如今的PFA技术为微秒脉冲电场消融技术(μsPFA),已有研究表明纳秒脉冲电场消融技术(nsPFA)能在保持有效性及安全性的前提下,能够解决现有PFA技术对麻醉要求高、肌肉收缩和患者疼痛感等问题,使PFA房颤消融手术更高效、安全。同时,导管设计将更加精细化和个性化,以适应不同的肺静脉解剖结构,提高消融效率。此外,PFA技术将继续优化脉冲波的频率、脉宽时间等参数,减少肌颤的发生。随着临床试验和研究的深入,PFA的应用范围有望从心房颤动扩展到其他心律失常,如室性心律失常。技术创新还包括导管的小型化和人工智能(AI)及机器学习算法的集成,以提高PFA程序的准确性和减少并发症的风险。总体而言,PFA技术的未来发展将使其在心脏消融治疗中占据更重要的位置,并为心律失常患者提供更安全、有效的治疗方案。
参考文献:
[1] BATISTA NAPOTNIK T, POLAJŽER T, MIKLAVČIČ D. Cell death due to electroporation –A review [J]. Bioelectrochemistry (Amsterdam, Netherlands), 2021, 141.
[2] VERMA A, ASIVATHAM S J, DENEKE T, et al. Primer on Pulsed Electrical Field Ablation [J]. Circulation: Arrhythmia and Electrophysiology, 2021, 14(9).
[3] RUBINSKY B. Irreversible electroporation in medicine [J]. Technology in cancer research & treatment, 2007, 6(4): 255-60.
[4] MAOR E, IVORRA A, LEOR J, et al. The effect of irreversible electroporation on blood vessels [J]. Technology in cancer research & treatment, 2007, 6(4): 307-12.
[5] LAVEE J, ONIK G, MIKUS P, et al. A novel nonthermal energy source for surgical epicardial atrial ablation: irreversible electroporation [J]. Heart Surg Forum, 2007, 10(2): E162-7.
[6] HAUER R N, STRAKS W, BORST C, et al. Electrical catheter ablation in the left and right ventricular wall in dogs: relation between delivered energy and histopathologic changes [J]. J Am Coll Cardiol, 1986, 8(3): 637-43.
[7] WIJFFELS M C, TIMMERMANS C C, VAN SUYLEN R J, et al. Internal atrial shock delivery by standard diagnostic electrophysiology catheters in goats: effects on atrial electrogram amplitude and tissue architecture [J]. Europace : European pacing, arrhythmias, and cardiac electrophysiology : journal of the working groups on cardiac pacing, arrhythmias, and cardiac cellular electrophysiology of the European Society of Cardiology, 2007, 9(4): 203-7.
[8] WITTKAMPF F H, VAN DRIEL V J, VAN WESSEL H, et al. Feasibility of electroporation for the creation of pulmonary vein ostial lesions [J]. Journal of cardiovascular electrophysiology, 2011, 22(3): 302-9.
[9] DESIMONE C V, KAPA S, ASIRVATHAM S J. Electroporation: past and future of catheter ablation [J]. Circulation Arrhythmia and electrophysiology, 2014, 7(4): 573-5.
[10] NAKAGAWA H, JACKMAN W M. Electroporation (revival of direct current ablation): new approach for increasing epicardial ablation safety in close proximity to a coronary artery [J]. Circulation Arrhythmia and electrophysiology, 2014, 7(5): 779-80.
[11] KUMAR S, BARBHAIYA C R, BALINDGER S, et al. Better Lesion Creation And Assessment During Catheter Ablation [J]. Journal of atrial fibrillation, 2015, 8(3): 1189.
[12] BARNETT A S, BAHNSON T D, PICCINI J P. Recent Advances in Lesion Formation for Catheter Ablation of Atrial Fibrillation [J]. Circulation Arrhythmia and electrophysiology, 2016, 9(5).
[13] VAIDYA V R, SUGURE A, ASIRVATHAM S J. Innovations in Clinical Cardiac Electrophysiology: Challenges and Upcoming Solutions in 2018 and Beyond [J]. The Journal of innovations in cardiac rhythm management, 2017, 8(12): 2943-55.
[14] SUGRUE A, ASIRVATHAM S J. Highlights from Heart Rhythm 2018: Innovative Techniques [J]. The Journal of innovations in cardiac rhythm management, 2018, 9(9): 3330-5.
[15] WITTKAMPF F H M, VAN ES R, NEVEN K. Electroporation and its Relevance for Cardiac Catheter Ablation [J]. JACC Clinical electrophysiology, 2018, 4(8): 977-86.
[16] KIRCHHOF P, LOH P, ECKARDT L, et al. A novel nonfluoroscopic catheter visualization system (LocaLisa) to reduce radiation exposure during catheter ablation of supraventricular tachycardias [J]. The American journal of cardiology, 2002, 90(3): 340-3.
